Quante volte ci siamo chiesti quanto saremmo ricchi se conoscessimo il segreto per fare i diamanti? È ovvio che nessuno di noi ha in mano questo, ma sappiamo, grazie alla scienza, quali sono i fenomeni fisici e chimici per cui, da un semplice pezzo di carbone la natura ci da queste preziose pietre. Vi spiegheremo questi fenomeni e capiremo insieme che ciò che accade non è possibile in una provetta e nemmeno in una semplice autoclave. Vi sveleremo il segreto per poter produrre dei cristalli di sale fatti in casa!
Ma cosa sono i cristalli?
Partiamo dalla definizione basilare: un cristallo è un solido formato da atomi ordinati nello spazio secondo una geometria per formare un reticolo cristallino. Poiché quest’ordine viene rispettato su tutto il solido, la forma finale del singolo cristallo sarà la stessa del reticolo nella sua parte più piccola. Mi spiego meglio: se il sale da cucina ha granelli più o meno cubici questo è dovuto al suo reticolo, che ha una geometria quadrata. In natura se ne trovano di varie forme oltre alla cubica, ad esempio esagonale, tetragonale (simile a cubo ma allungato), ortorombico (come il tetragonale ma la cui base o sezione ha la forma di un rombo), trigonale e così via.
È la natura degli atomi che compone il reticolo che dà la forma al reticolo stesso, e che definisce le sue caratteristiche fisiche e la sua grandezza.
Allora qualsiasi solido è un cristallo?
Ogni solido è costituito da molecole e atomi, ma è l’ordine di questi che conferisce all’oggetto le sue proprietà fisiche. Un esempio pratico: quando impiliamo una serie di fogli o libri in più colonne, possiamo ottenere forme tetragonali o cubiche, ma se questi fossero posti male o a casaccio? Nonostante il foglio o il libro abbiano forma rettangolare, avremo nell’insieme un’accozzaglia senza forma.
Un esempio curioso è quello del fosforo. Sebbene sia sempre fosforo, allo stato puro (elementare) lo troviamo in varie forme e colori. Citiamo il fosforo rosso e il fosforo bianco, entrambi sono costituiti da atomi ordinati a gruppi tetraedrici, ma solo il fosforo bianco brucia quando messo all’aria aperta. Questo accade perché non è rispettata la geometria tetraedrica all’interno dell’intero solido, non c’è un reticolo ordinato e questo viene definito come amorfo. Anche il vetro è un materiale amorfo, è costituito da atomi di silicio e ossigeno anch’essi legati in modo da dare una geometria tetraedrica, ma nello spazio questi tetraedri sono sparpagliati casualmente. Questo comporta che i materiali amorfi non abbiano una forma finale ben definita. Il vetro è malleabile, il fosforo rosso è granuloso e al microscopio non ha alcuna geometria definita.

E quindi? Cosa c’entra coi diamanti?
I diamanti sono fatti solamente di atomi di carbonio, ma anche il semplice carbone è fatto della stessa materia. Dopo quanto spiegato, possiamo dedurre che questi oggetti abbiano un reticolo cristallino differente. Infatti il carbone è un materiale amorfo, mentre il diamante è costituito da un reticolo cristallino praticamente perfetto. L’unità geometrica di partenza è l’ottaedro ( o esacisottaedro, tetraedrico o ancora composto da rombododecaedri e cubi). Quest’ordine perfetto del reticolo conferisce al diamante la tipica trasparenza e rifrazione della luce.
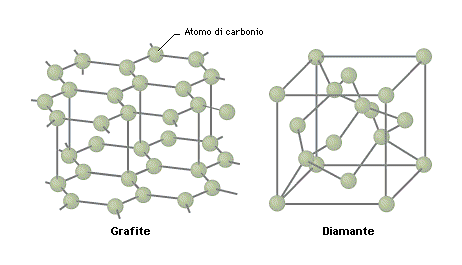
Come è possibile che in natura si trovino carbone e diamanti?
Sono le condizioni ambientali a influenzare la forma di un materiale. Se ci pensiamo, i diamanti si trovano in giacimenti, o all’aperto (più comuni), o a pozzo. Ciò che succede alla maggior parte di questi diamanti è che si formano grazie al materiale organico, che troviamo alla profondità di 200 km nella crosta terrestre con temperature pari a 1500-2000 °C sotto 70 tonnellate di terra per centimetro quadro. Parliamo di materiale carbonioso che emerge assieme alle rocce sedimentarie o rocce madri dagli strati più profondi della crosta terrestre. Immaginate quindi che per produrre diamanti non sia cosa facile. Dopotutto arrivare a temperature e pressioni così elevate richiede un enorme quantitativo di energia, ecco perché non converrebbe sintetizzare diamanti per scopi di gioielleria. Piuttosto avrebbe senso sintetizzare piccole punte di diamanti come strumenti di precisione per produzioni in scala industriale. Perché oltre alla brillantezza e trasparenza sappiamo anche che il diamante è uno dei materiali più resistenti e leggeri conosciuti dall’uomo.
Come ottenere cristalli fighissimi
Ecco, dopo questa importante delusione, vogliamo donarvi questa fantastica ricetta per preparare a casa dei fantastici cristalli! Tutto ciò che serve è: 3 bicchieri di vetro, acqua, pentolino o bollitore per l’acqua, un filo (nylon o spago sottile), una bacchetta di legno, pellicola (o stagnola),una vaschetta di plastica e, infine, il sale da cristallizzare. Il sale il questione potrebbe essere anche il comune sale da cucina ma per dei fantastici cristalli dalla forma esagonale vi invitiamo a procurarvi dell’Allume di Rocca (detta anche di potassio). Avete l’occorrente? Iniziamo!
Servono 20g di allume (o sale) da sciogliere in 100 g di acqua. Per comodità, invece di scaldare la soluzione, usiamo dell’acqua già scaldata. Basta aver portato i 100g di acqua ad ebollizione con un bollitore o con un pentolino. Quindi una volta messi in un bicchiere di vetro allume e acqua, agitiamo con una bacchetta di legno pulita e copriamo il bicchiere con pellicola. Questo per evitare di far evaporare troppa acqua. Aspettiamo che si raffreddi. Dopodiché se si trova sul fondo del bicchiere qualche granello, dovremo travasare la soluzione in un secondo bicchiere. Dopo una mezz’ora la soluzione sarà fredda. Qui toccherà portare la soluzione dentro una vaschetta larga e poco profonda, un paio di centimetri alta di soluzione. Dopo 2-3 giorni potremo prelevare i cristalli.
Già dopo le prime 24 ore saranno visibili i primi cristalli. Questi, non troppo trasparenti, sono il risultato di una evaporazione troppo veloce e dipende dalla temperatura dell’ambiente: più è alta, più velocemente l’acqua evapora. Il segreto per evitare l’opacizzazione sta nel bloccare l’evaporazione ponendo una pellicola con alcuni buchi sopra la bacinella. Rallenteremo la crescita ma i cristalli saranno trasparenti! In ogni caso più tempo passa più i cristalli cresceranno.

Ora siamo nella seconda fase: facciamo crescere i cristalli che abbiamo ottenuto! Dopo una selezione dei migliori cristalli, prepariamo un’altra soluzione di acqua da 200 grammi con 30 grammi di allume, come abbiamo fatto prima. Lasciamo raffreddare e mettiamo la soluzione in dei bicchieri di vetro, e questa volta dovremo agganciare il cristallo ad un filo e agganciarlo a un sostegno in modo che il cristallo stia a penzoloni a metà bicchiere. Man mano che cresce, l’acqua evapora e quando notiamo che troppa acqua è scomparsa riprepariamo un’altra soluzione. Tutto qua! Ecco come ottenere dei bellissimi cristalli bianchi e trasparenti in modo semplice! Per ottenere dei cristalli ancora più belli vi suggeriamo di mettere del colorante alimentare nelle soluzioni che preparerete. Vi sembrerà di ottenere dei minerali preziosi semplicemente in casa.
Salvatore Donato
Bibliografia
https://it.wikipedia.org/wiki/Diamante#Estrazione
 UniVersoMe Testata Multiforme degli Studenti UNIME
UniVersoMe Testata Multiforme degli Studenti UNIME

